Bộ KH&CN và Bộ Y tế nói gì về vụ nâng khống giá test kit COVID-19 của Công ty Việt Á?
22/12/2021 - Liên quan đến việc trang web của Bộ KH&CN gỡ thông tin về kit test thử của Công ty Việt Á: Ai chịu trách nhiệm về tính liêm chính của thông tin khoa học?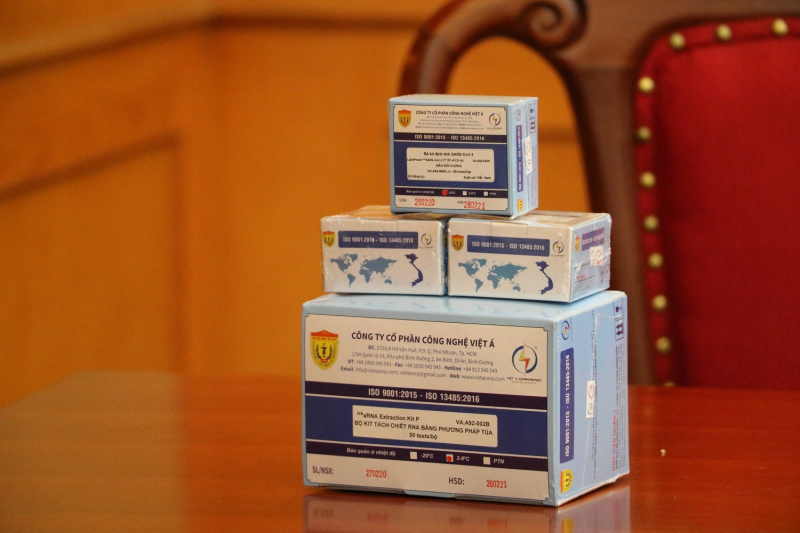
Bộ kit xét nghiệm COVID-19 của Công ty
Việt Á đang thu hút sự quan tâm của dư luận.
Ngày 21/12, thông tin công bố đánh giá của Tổ chức Y tế Thế giới (WHO) và Bộ Y tế Anh cấp chứng nhận đạt chuẩn châu Âu cho bộ kit test của Công ty cổ phần Công nghệ Việt Á (gọi tắt là Công ty Việt Á) được đăng trên website của Bộ Khoa học và Công nghệ (KH&CN) từ tháng 4/2020, đã bị gỡ bỏ. Việc gỡ bỏ thông tin sau đó đã được đại diện Vụ Khoa học và Công nghệ của Bộ thừa nhận “miệng” là “sai sót”, song lãnh đạo Bộ KH&CN, lãnh đạo website của Bộ KH&CN dường như cố tình “bơ” đi, không có một dòng đính chính về sự việc nói trên.Ngày 26/4/2020, Cổng thông tin điện tử của Bộ KH&CN đăng tải: "Bộ kit xét nghiệm COVID-19 của Việt Nam sản xuất vừa được Tổ chức Y tế Thế giới chấp thuận", trong đó nêu rõ: "Ngày 24/4, Tổ chức Y tế Thế giới đã chấp thuận bộ kit xét nghiệm COVID-19 của Việt Nam do Bộ KH&CN giao cho Học viện Quân y và Công ty cổ phần Công nghệ Việt Á phối hợp nghiên cứu và sản xuất. WHO đã đánh giá bộ kit theo quy trình danh sách khẩn cấp (EUL) và cấp mã số EUL 0524-210-00".
Thế nhưng, trên thực tế, WHO đã liệt bộ kit xét nghiệm COVID-19 của Công ty Việt Á vào danh sách sản phẩm không được chấp thuận cho EUL (Emergency Use Listing - danh sách sử dụng khẩn cấp) trong cập nhật mới nhất ngày 10/12/2021.
Theo WHO, bộ kit Light Power iVASARS-CoV-2 1stRT-rPCR (mã số EUL: EUL 0524-210-00) không được chấp nhận nên không đạt điều kiện tham gia đấu thầu của WHO. WHO yêu cầu Công ty Việt Á phải cung cấp thông tin mới nhất về tình trạng của hệ thống quản lý chất lượng của họ.
Trước thông tin này, ngày 21/12/2021, Bộ KH&CN đã “lặng lẽ” rút thông tin đã đăng từ năm 2020. Theo đại diện Bộ KH&CN, do sai sót thông tin nên gỡ bài viết đánh giá của WHO về bộ kit test SARS-CoV-2 của Công ty Việt Á trên trang web của Bộ. Về lý do, ngày 20/12, ông Trịnh Thanh Hùng, Phó Vụ trưởng Vụ Khoa học và Công nghệ các khối ngành Kinh tế - Kỹ thuật, Bộ KH&CN thừa nhận với một số báo rằng: "Bộ chưa xem xét kỹ lưỡng thông tin phản hồi của WHO về bộ kit test của Công ty Việt Á. Thực chất WHO mới chỉ "chấp thuận đưa kit test này vào quy trình đánh giá xem xét sử dụng" không phải "chấp thuận sử dụng".
Đây là sơ suất của Bộ KH&CN. Về băn khoăn kit test không được WHO chấp thuận nhưng vẫn đưa sản phẩm này vào sử dụng trong 2 năm chống dịch, ông Hùng nhấn mạnh, việc WHO chấp nhận hay không chấp nhận độc lập với quyết định cấp phép sử dụng của Bộ Y tế.
Cụ thể, ngày 4/3/2020, theo đề nghị của Bộ KH&CN, Bộ Y tế đồng ý cho sinh phẩm chẩn đoán invitro xét nghiệm virus SARS-CoV-2 do Học viện Quân y và Công ty cổ phần Công nghệ Việt Á sản xuất được cấp số đăng ký để phục vụ kịp thời công tác phòng, chống dịch COVID-19.
Sản phẩm này là kết quả của đề tài nghiên cứu cấp quốc gia được Bộ KH&CN đặt hàng Học viện Quân y chủ trì, phối hợp với Công ty cổ phần Công nghệ Việt Á thực hiện. Đề tài được nghiệm thu và thông qua. Do đó, bộ kit test này đủ điều kiện để các cơ sở y tế sử dụng trong nước phục vụ công tác phòng, chống dịch.
Xung quanh việc gỡ bỏ thông tin trên trang web của Bộ KH&CN, ngày 21/12, phóng viên Báo CAND tìm mọi cách liên hệ với lãnh đạo Bộ KH&CN với mong muốn có câu trả lời chính thống nhưng không ai bắt máy. Chỉ duy nhất một chuyên viên hồi âm: “Hiện Bộ chưa có thông cáo báo chí về vấn đề kit test của Công ty cổ phần Công nghệ Việt Á nói chung và vấn đề gỡ bỏ thông tin trên trang web nói riêng. Khi nào có chúng tôi sẽ gửi tới Quý báo”.
Trên thực tế, sự im lặng của lãnh đạo Bộ KH&CN khiến dư luận băn khoăn. Vì thông tin đăng trên trang web chính là một trong những nguồn tin chính thống của Bộ. Người dân, các đơn vị sẽ cảm thấy tin tưởng hơn rất nhiều khi đọc được những thông tin bổ ích từ đây, nhất là thông tin về các công trình khoa học. Đặc biệt, việc này liên quan đến một công ty vừa bị khởi tố và bắt giam nhiều đối tượng do các vi phạm liên quan đến kit test.
Thiết nghĩ, trang web của một bộ là nơi đăng tải những thông tin chính thống, thể hiện trách nhiệm xã hội. Do đó, khi đăng một thông tin về thành tựu khoa học, nhất là trong hoàn cảnh cả nước đang mong chờ một “cây đũa thần” góp phần phòng, chống đại dịch, thì thông tin đó phải đảm bảo tính chính xác tuyệt đối. Việc tự ý gỡ bỏ thông tin, mà không có lời giải thích khiến dư luận hoài nghi về tính liêm chính của một thông tin khoa học quan trọng?
Phạm Huyền
https://cand.com.vn/phap-luat/ai-chiu-trach-nhiem-ve-tinh-liem-chinh-cua-thong-tin-khoa-hoc--i638871/
Bộ Y tế nói gì về vụ nâng khống giá test kit COVID-19 của Công ty Việt Á?
21/12/2021 Sau 3 ngày vụ việc nâng khống giá sinh phẩm xét nghiệm COVID-19 tại Công ty cổ phần Công nghệ Việt Á bị phanh phui, ngày 21/12, Bộ Y tế đã lên tiếng về vấn đề này. Theo Bộ Y tế, việc nâng khống giá bộ xét nghiệm COVID-19 của Công ty cổ phần Công nghệ Việt Á là rất nghiêm trọng, cần phải được xử lý nghiêm minh.
Vụ nâng khống giá kit test COVID-19: Nhiều câu hỏi cần được làm rõ
Chiều 21/12, Bộ Y tế phát đi thông cáo khẳng định thực hiện đúng quy định trong cấp phép lưu hành sinh phẩm xét nghiệm của Công ty cổ phần Công nghệ Việt Á (gọi tắt là Công ty Việt Á) và bảo đảm chất lượng sinh phẩm xét nghiệm COVID-19.
Thực hiện đúng quy định cấp phép lưu hành sản phẩm của Việt Á
Theo Bộ Y tế, thực hiện Quyết định số 489/QĐ-BKHCN ngày 2/3/2020 của Bộ trưởng Bộ Khoa học và Công nghệ, ngày 3/3/2020, Hội đồng đánh giá, nghiệm thu kết quả giai đoạn 1 đề tài độc lập cấp quốc gia đột xuất phòng chống dịch bệnh viêm đường hô hấp cấp do chủng mới của virus corona: “Nghiên cứu chế tạo bộ sinh phẩm RT-PCR và realtime RT-PCR phát hiện chủng virus corona mới 2019 (2019-nCoV)” đã họp và đề nghị Bộ Y tế cấp phép sử dụng cho 2 bộ sinh phẩm realtime PCR chẩn đoán SARS-CoV-2 (LightPoweriVA SARS-CoV-2 1st RT-PCR Kit, LightPoweriVA SARS-CoV-2 1st RT-rPCR Kit). Đây là kết quả của nhiệm vụ khoa học và công nghệ cấp quốc gia do Bộ Khoa học và Công nghệ phê duyệt, được thực hiện giữa Học viện Quân y và Công ty Việt Á.
Căn cứ vào ý kiến của Hội đồng nói trên, kết quả đánh giá đáp ứng về độ nhạy và độ đặc hiệu của Viện Vệ sinh dịch tễ Trung ương, kết quả xác nhận cơ sở sản xuất của Công ty đã đạt tiêu chuẩn ISO 13485:2016 do Tổ chức Bureau Veritas cấp (đây là tổ chức đã được Bộ Khoa học và Công nghệ công nhận) và theo các quy định tại Nghị định 36/2016/NĐ-CP, Nghị định 169/2018/NĐ-CP, Bộ Y tế đã cấp phép sử dụng tạm thời cho 2 bộ sinh phẩm nói trên trong thời hạn 6 tháng vào ngày 4/3/2020 để sử dụng trong xét nghiệm sàng lọc. Việc cấp phép này đã đảm bảo đáp ứng nhu cầu xét nghiệm tại thời điểm rất khó khăn khi tiếp cận với nguồn cung ứng sinh phẩm trên thế giới.
Đến ngày 4/12/2020, Bộ Y tế đã có Quyết định số 5071/QĐ-BYT cấp phép lưu hành 5 năm đối với bộ sinh phẩm xét nghiệm SARS-CoV-2 chủng loại LightPoweriVA SARS-CoV-2 1st RT-rPCR Kit của Công ty Việt Á. Cũng tại Quyết định trên, Bộ Y tế cấp phép lưu hành cho sinh phẩm xét nghiệm SARS-CoV-2 chủng loại One-Step RT- PCR COVID-19 Kit Thai Duong Multiplex-3 target genes Version 1.0 của Công ty cổ phần Sao Thái Dương.
Tính đến ngày 20/12/2021, Bộ Y tế đã cấp phép 146 sinh phẩm xét nghiệm SARS-CoV-2, trong đó có 46 sinh phẩm xét nghiệm vật liệu di truyền (PCR, LAMP) tương tự như sản phẩm của Công ty Việt Á và Công ty cổ phần Sao Thái Dương (bao gồm 7 sinh phẩm sản xuất trong nước và 39 sinh phẩm nhập khẩu). Bộ Y tế xác định việc cấp phép cho nhiều sản phẩm là để tăng cường nội địa hóa, chủ động nguồn cung và tạo sự cạnh tranh về giá sinh phẩm xét nghiệm.
Tất cả các sản phẩm cấp phép đều đã được đánh giá đạt yêu cầu, đáp ứng tiêu chuẩn, chất lượng của Việt Nam và đảm bảo đúng theo các quy định hiện hành. Các sản phẩm sau khi được cấp phép đều được theo dõi chất lượng và tính ổn định.
Về việc kit test của Công ty Việt Á không được Tổ chức Y tế thế giới (WHO) cấp phép, Bộ Y tế giải thích: Về danh mục các sinh phẩm do WHO công bố và đưa vào danh sách sử dụng khẩn cấp (EUL), các công ty mong muốn sản phẩm của mình được đưa vào danh sách của WHO thì nộp hồ sơ đề nghị WHO xem xét. Tuy nhiên, mỗi quốc gia, tổ chức đều xây dựng tiêu chí và yêu cầu về hồ sơ, sản phẩm khác nhau về việc chấp thuận lưu hành sinh phẩm. Các công ty có nhu cầu lưu hành, sử dụng tại quốc gia và tổ chức nào sẽ nộp hồ sơ theo quy định của từng tổ chức, quốc gia đó.
"Do vậy, việc cấp phép của Bộ Y tế đối với sản phẩm của Công ty cổ phần Công nghệ Việt Á và các nhà sản xuất khác không phụ thuộc vào danh sách do WHO công bố", Bộ Y tế khẳng định.
Tính đến nay, đối với sinh phẩm xét nghiệm PCR, theo danh sách EUL của WHO có 23 sản phẩm được phê duyệt. Trong khi đó, tại châu Âu đã chấp thuận 589 loại sinh phẩm, Mỹ chấp thuận sử dụng 276 loại sinh phẩm, Hàn Quốc chấp thuận sử dụng trong nước 31 sinh phẩm...
Giá sinh phẩm xét nghiệm phải qua đấu thầu, công khai
Về giá sinh phẩm xét nghiệm, Bộ Y tế cho biết, phải thông qua đấu thầu công khai, minh bạch. Theo quy định của Luật giá, trang thiết bị y tế và sinh phẩm xét nghiệm không thuộc trong danh mục mặt hàng phải quản lý giá. Giá trang thiết bị y tế và sinh phẩm xét nghiệm được xác định thông qua đấu thầu và giá các sản phẩm khác nhau theo từng thời điểm và số lượng mua sắm, khả năng cung ứng.
Bộ Y tế đã hướng dẫn, đôn đốc, yêu cầu các doanh nghiệp cung ứng trên thị trường triển khai thực hiện việc công khai giá trang thiết bị y tế và công khai kết quả trúng thầu. Hiện tại, trên Cổng công khai giá trang thiết bị y tế đã có trên 1.600 doanh nghiệp thực hiện công khai giá bán (giá niêm yết theo quy định của Luật giá), có trên 60.000 mặt hàng trang thiết bị y tế công khai giá (8.256 thiết bị y tế; 36.191 vật tư y tế; 15.584 IVD) và 93.253 kết quả trúng thầu.
Cùng thời điểm Công ty Việt Á niêm yết giá trên Cổng công khai giá là 470.000 đồng/sản phẩm, thì Công ty cổ phần Sao Thái Dương niêm yết giá loại xét nghiệm PCR là 300.000 đồng/sản phẩm và xét nghiệm LAMP có giá 385.000 đồng/sản phẩm; Công ty Ampharco U.S.A niêm yết giá 179.800 đồng/sản phẩm; có 15 sản phẩm PCR nhập khẩu đã được cấp phép đăng ký và niêm yết giá từ 280.000 đồng đến 600.000 đồng/sản phẩm.
Thông tin này đã được công khai trên Cổng công khai giá để các địa phương, cơ sở y tế nắm bắt, tham khảo khi xây dựng kế hoạch và thực hiện mua sắm, đấu thầu, sử dụng sản phẩm phục vụ nhu cầu phòng, chống dịch, mà không phải là giá bắt buộc áp dụng. Các địa phương, đơn vị thực hiện mua sắm, đấu thầu theo đúng quy định và chịu trách nhiệm về kết quả thực hiện.
Bộ Y tế cho biết, Bộ thực hiện nhiều biện pháp để đảm bảo nguồn cung và giảm giá, trong đó tập trung ưu tiên đẩy mạnh việc cấp giấy phép nhập khẩu và sản xuất trong nước để tăng số lượng mặt hàng cung ứng trên thị trường, nhằm tăng sự cạnh tranh, giảm giá sản phẩm. Mặt khác, Bộ Y tế cũng đã hướng dẫn các đơn vị, địa phương gộp mẫu 10, 15 cho 1 xét nghiệm PCR để giảm chi phí xét nghiệm.
Bộ Y tế đã có các văn bản đề nghị các đơn vị sản xuất và kinh doanh xem xét giảm giá bán sinh phẩm xét nghiệm để hỗ trợ cho các đơn vị chống dịch. Đến nay, về cơ bản hầu hết các sản phẩm đã được giảm giá.
Đồng thời có công văn gửi các đơn vị sản xuất, nhập khẩu và cung ứng sinh phẩm xét nghiệm, nghiêm cấm việc tăng giá hoặc đầu cơ, tích trữ và nghiêm túc thực hiện việc cập nhật, rà soát, công khai minh bạch về giá trên Cổng điện tử công khai giá. Đồng thời chịu trách nhiệm về giá công bố và tính chính xác, đầy đủ các thông tin liên quan đến hàng hóa theo quy định.
Bộ Y tế khẳng định cương quyết phòng chống tiêu cực, tham nhũng trong mua sắm, đấu thầu. Đối với những vấn đề liên quan đến tham nhũng, tiêu cực, lợi ích nhóm trong công tác phòng dịch, thời gian qua, Bộ Y tế đã có nhiều văn bản chỉ đạo, chấn chỉnh trong công tác mua sắm, đấu thầu và sử dụng trang thiết bị phòng chống dịch, trong đó có sinh phẩm xét nghiệm.
Bộ Y tế cho biết, việc nâng khống giá bộ xét nghiệm COVID-19 của Công ty Việt Á là rất nghiêm trọng, cần phải được xử lý nghiêm minh.
https://cand.com.vn/su-kien-binh-luan-thoi-su/bo-y-te-noi-gi-ve-vu-nang-khong-gia-test-kit-covid-19-cua-cong-ty-viet-a--i638820/
Thế nhưng, trên thực tế, WHO đã liệt bộ kit xét nghiệm COVID-19 của Công ty Việt Á vào danh sách sản phẩm không được chấp thuận cho EUL (Emergency Use Listing - danh sách sử dụng khẩn cấp) trong cập nhật mới nhất ngày 10/12/2021.
Theo WHO, bộ kit Light Power iVASARS-CoV-2 1stRT-rPCR (mã số EUL: EUL 0524-210-00) không được chấp nhận nên không đạt điều kiện tham gia đấu thầu của WHO. WHO yêu cầu Công ty Việt Á phải cung cấp thông tin mới nhất về tình trạng của hệ thống quản lý chất lượng của họ.
Trước thông tin này, ngày 21/12/2021, Bộ KH&CN đã “lặng lẽ” rút thông tin đã đăng từ năm 2020. Theo đại diện Bộ KH&CN, do sai sót thông tin nên gỡ bài viết đánh giá của WHO về bộ kit test SARS-CoV-2 của Công ty Việt Á trên trang web của Bộ. Về lý do, ngày 20/12, ông Trịnh Thanh Hùng, Phó Vụ trưởng Vụ Khoa học và Công nghệ các khối ngành Kinh tế - Kỹ thuật, Bộ KH&CN thừa nhận với một số báo rằng: "Bộ chưa xem xét kỹ lưỡng thông tin phản hồi của WHO về bộ kit test của Công ty Việt Á. Thực chất WHO mới chỉ "chấp thuận đưa kit test này vào quy trình đánh giá xem xét sử dụng" không phải "chấp thuận sử dụng".
Đây là sơ suất của Bộ KH&CN. Về băn khoăn kit test không được WHO chấp thuận nhưng vẫn đưa sản phẩm này vào sử dụng trong 2 năm chống dịch, ông Hùng nhấn mạnh, việc WHO chấp nhận hay không chấp nhận độc lập với quyết định cấp phép sử dụng của Bộ Y tế.
Cụ thể, ngày 4/3/2020, theo đề nghị của Bộ KH&CN, Bộ Y tế đồng ý cho sinh phẩm chẩn đoán invitro xét nghiệm virus SARS-CoV-2 do Học viện Quân y và Công ty cổ phần Công nghệ Việt Á sản xuất được cấp số đăng ký để phục vụ kịp thời công tác phòng, chống dịch COVID-19.
Sản phẩm này là kết quả của đề tài nghiên cứu cấp quốc gia được Bộ KH&CN đặt hàng Học viện Quân y chủ trì, phối hợp với Công ty cổ phần Công nghệ Việt Á thực hiện. Đề tài được nghiệm thu và thông qua. Do đó, bộ kit test này đủ điều kiện để các cơ sở y tế sử dụng trong nước phục vụ công tác phòng, chống dịch.
Xung quanh việc gỡ bỏ thông tin trên trang web của Bộ KH&CN, ngày 21/12, phóng viên Báo CAND tìm mọi cách liên hệ với lãnh đạo Bộ KH&CN với mong muốn có câu trả lời chính thống nhưng không ai bắt máy. Chỉ duy nhất một chuyên viên hồi âm: “Hiện Bộ chưa có thông cáo báo chí về vấn đề kit test của Công ty cổ phần Công nghệ Việt Á nói chung và vấn đề gỡ bỏ thông tin trên trang web nói riêng. Khi nào có chúng tôi sẽ gửi tới Quý báo”.
Trên thực tế, sự im lặng của lãnh đạo Bộ KH&CN khiến dư luận băn khoăn. Vì thông tin đăng trên trang web chính là một trong những nguồn tin chính thống của Bộ. Người dân, các đơn vị sẽ cảm thấy tin tưởng hơn rất nhiều khi đọc được những thông tin bổ ích từ đây, nhất là thông tin về các công trình khoa học. Đặc biệt, việc này liên quan đến một công ty vừa bị khởi tố và bắt giam nhiều đối tượng do các vi phạm liên quan đến kit test.
Thiết nghĩ, trang web của một bộ là nơi đăng tải những thông tin chính thống, thể hiện trách nhiệm xã hội. Do đó, khi đăng một thông tin về thành tựu khoa học, nhất là trong hoàn cảnh cả nước đang mong chờ một “cây đũa thần” góp phần phòng, chống đại dịch, thì thông tin đó phải đảm bảo tính chính xác tuyệt đối. Việc tự ý gỡ bỏ thông tin, mà không có lời giải thích khiến dư luận hoài nghi về tính liêm chính của một thông tin khoa học quan trọng?
Phạm Huyền
https://cand.com.vn/phap-luat/ai-chiu-trach-nhiem-ve-tinh-liem-chinh-cua-thong-tin-khoa-hoc--i638871/
Bộ Y tế nói gì về vụ nâng khống giá test kit COVID-19 của Công ty Việt Á?
21/12/2021 Sau 3 ngày vụ việc nâng khống giá sinh phẩm xét nghiệm COVID-19 tại Công ty cổ phần Công nghệ Việt Á bị phanh phui, ngày 21/12, Bộ Y tế đã lên tiếng về vấn đề này. Theo Bộ Y tế, việc nâng khống giá bộ xét nghiệm COVID-19 của Công ty cổ phần Công nghệ Việt Á là rất nghiêm trọng, cần phải được xử lý nghiêm minh.
Vụ nâng khống giá kit test COVID-19: Nhiều câu hỏi cần được làm rõ
Chiều 21/12, Bộ Y tế phát đi thông cáo khẳng định thực hiện đúng quy định trong cấp phép lưu hành sinh phẩm xét nghiệm của Công ty cổ phần Công nghệ Việt Á (gọi tắt là Công ty Việt Á) và bảo đảm chất lượng sinh phẩm xét nghiệm COVID-19.
Thực hiện đúng quy định cấp phép lưu hành sản phẩm của Việt Á
Theo Bộ Y tế, thực hiện Quyết định số 489/QĐ-BKHCN ngày 2/3/2020 của Bộ trưởng Bộ Khoa học và Công nghệ, ngày 3/3/2020, Hội đồng đánh giá, nghiệm thu kết quả giai đoạn 1 đề tài độc lập cấp quốc gia đột xuất phòng chống dịch bệnh viêm đường hô hấp cấp do chủng mới của virus corona: “Nghiên cứu chế tạo bộ sinh phẩm RT-PCR và realtime RT-PCR phát hiện chủng virus corona mới 2019 (2019-nCoV)” đã họp và đề nghị Bộ Y tế cấp phép sử dụng cho 2 bộ sinh phẩm realtime PCR chẩn đoán SARS-CoV-2 (LightPoweriVA SARS-CoV-2 1st RT-PCR Kit, LightPoweriVA SARS-CoV-2 1st RT-rPCR Kit). Đây là kết quả của nhiệm vụ khoa học và công nghệ cấp quốc gia do Bộ Khoa học và Công nghệ phê duyệt, được thực hiện giữa Học viện Quân y và Công ty Việt Á.
Căn cứ vào ý kiến của Hội đồng nói trên, kết quả đánh giá đáp ứng về độ nhạy và độ đặc hiệu của Viện Vệ sinh dịch tễ Trung ương, kết quả xác nhận cơ sở sản xuất của Công ty đã đạt tiêu chuẩn ISO 13485:2016 do Tổ chức Bureau Veritas cấp (đây là tổ chức đã được Bộ Khoa học và Công nghệ công nhận) và theo các quy định tại Nghị định 36/2016/NĐ-CP, Nghị định 169/2018/NĐ-CP, Bộ Y tế đã cấp phép sử dụng tạm thời cho 2 bộ sinh phẩm nói trên trong thời hạn 6 tháng vào ngày 4/3/2020 để sử dụng trong xét nghiệm sàng lọc. Việc cấp phép này đã đảm bảo đáp ứng nhu cầu xét nghiệm tại thời điểm rất khó khăn khi tiếp cận với nguồn cung ứng sinh phẩm trên thế giới.
Đến ngày 4/12/2020, Bộ Y tế đã có Quyết định số 5071/QĐ-BYT cấp phép lưu hành 5 năm đối với bộ sinh phẩm xét nghiệm SARS-CoV-2 chủng loại LightPoweriVA SARS-CoV-2 1st RT-rPCR Kit của Công ty Việt Á. Cũng tại Quyết định trên, Bộ Y tế cấp phép lưu hành cho sinh phẩm xét nghiệm SARS-CoV-2 chủng loại One-Step RT- PCR COVID-19 Kit Thai Duong Multiplex-3 target genes Version 1.0 của Công ty cổ phần Sao Thái Dương.
Tính đến ngày 20/12/2021, Bộ Y tế đã cấp phép 146 sinh phẩm xét nghiệm SARS-CoV-2, trong đó có 46 sinh phẩm xét nghiệm vật liệu di truyền (PCR, LAMP) tương tự như sản phẩm của Công ty Việt Á và Công ty cổ phần Sao Thái Dương (bao gồm 7 sinh phẩm sản xuất trong nước và 39 sinh phẩm nhập khẩu). Bộ Y tế xác định việc cấp phép cho nhiều sản phẩm là để tăng cường nội địa hóa, chủ động nguồn cung và tạo sự cạnh tranh về giá sinh phẩm xét nghiệm.
Tất cả các sản phẩm cấp phép đều đã được đánh giá đạt yêu cầu, đáp ứng tiêu chuẩn, chất lượng của Việt Nam và đảm bảo đúng theo các quy định hiện hành. Các sản phẩm sau khi được cấp phép đều được theo dõi chất lượng và tính ổn định.
Về việc kit test của Công ty Việt Á không được Tổ chức Y tế thế giới (WHO) cấp phép, Bộ Y tế giải thích: Về danh mục các sinh phẩm do WHO công bố và đưa vào danh sách sử dụng khẩn cấp (EUL), các công ty mong muốn sản phẩm của mình được đưa vào danh sách của WHO thì nộp hồ sơ đề nghị WHO xem xét. Tuy nhiên, mỗi quốc gia, tổ chức đều xây dựng tiêu chí và yêu cầu về hồ sơ, sản phẩm khác nhau về việc chấp thuận lưu hành sinh phẩm. Các công ty có nhu cầu lưu hành, sử dụng tại quốc gia và tổ chức nào sẽ nộp hồ sơ theo quy định của từng tổ chức, quốc gia đó.
"Do vậy, việc cấp phép của Bộ Y tế đối với sản phẩm của Công ty cổ phần Công nghệ Việt Á và các nhà sản xuất khác không phụ thuộc vào danh sách do WHO công bố", Bộ Y tế khẳng định.
Tính đến nay, đối với sinh phẩm xét nghiệm PCR, theo danh sách EUL của WHO có 23 sản phẩm được phê duyệt. Trong khi đó, tại châu Âu đã chấp thuận 589 loại sinh phẩm, Mỹ chấp thuận sử dụng 276 loại sinh phẩm, Hàn Quốc chấp thuận sử dụng trong nước 31 sinh phẩm...
Giá sinh phẩm xét nghiệm phải qua đấu thầu, công khai
Về giá sinh phẩm xét nghiệm, Bộ Y tế cho biết, phải thông qua đấu thầu công khai, minh bạch. Theo quy định của Luật giá, trang thiết bị y tế và sinh phẩm xét nghiệm không thuộc trong danh mục mặt hàng phải quản lý giá. Giá trang thiết bị y tế và sinh phẩm xét nghiệm được xác định thông qua đấu thầu và giá các sản phẩm khác nhau theo từng thời điểm và số lượng mua sắm, khả năng cung ứng.
Bộ Y tế đã hướng dẫn, đôn đốc, yêu cầu các doanh nghiệp cung ứng trên thị trường triển khai thực hiện việc công khai giá trang thiết bị y tế và công khai kết quả trúng thầu. Hiện tại, trên Cổng công khai giá trang thiết bị y tế đã có trên 1.600 doanh nghiệp thực hiện công khai giá bán (giá niêm yết theo quy định của Luật giá), có trên 60.000 mặt hàng trang thiết bị y tế công khai giá (8.256 thiết bị y tế; 36.191 vật tư y tế; 15.584 IVD) và 93.253 kết quả trúng thầu.
Cùng thời điểm Công ty Việt Á niêm yết giá trên Cổng công khai giá là 470.000 đồng/sản phẩm, thì Công ty cổ phần Sao Thái Dương niêm yết giá loại xét nghiệm PCR là 300.000 đồng/sản phẩm và xét nghiệm LAMP có giá 385.000 đồng/sản phẩm; Công ty Ampharco U.S.A niêm yết giá 179.800 đồng/sản phẩm; có 15 sản phẩm PCR nhập khẩu đã được cấp phép đăng ký và niêm yết giá từ 280.000 đồng đến 600.000 đồng/sản phẩm.
Thông tin này đã được công khai trên Cổng công khai giá để các địa phương, cơ sở y tế nắm bắt, tham khảo khi xây dựng kế hoạch và thực hiện mua sắm, đấu thầu, sử dụng sản phẩm phục vụ nhu cầu phòng, chống dịch, mà không phải là giá bắt buộc áp dụng. Các địa phương, đơn vị thực hiện mua sắm, đấu thầu theo đúng quy định và chịu trách nhiệm về kết quả thực hiện.
Bộ Y tế cho biết, Bộ thực hiện nhiều biện pháp để đảm bảo nguồn cung và giảm giá, trong đó tập trung ưu tiên đẩy mạnh việc cấp giấy phép nhập khẩu và sản xuất trong nước để tăng số lượng mặt hàng cung ứng trên thị trường, nhằm tăng sự cạnh tranh, giảm giá sản phẩm. Mặt khác, Bộ Y tế cũng đã hướng dẫn các đơn vị, địa phương gộp mẫu 10, 15 cho 1 xét nghiệm PCR để giảm chi phí xét nghiệm.
Bộ Y tế đã có các văn bản đề nghị các đơn vị sản xuất và kinh doanh xem xét giảm giá bán sinh phẩm xét nghiệm để hỗ trợ cho các đơn vị chống dịch. Đến nay, về cơ bản hầu hết các sản phẩm đã được giảm giá.
Đồng thời có công văn gửi các đơn vị sản xuất, nhập khẩu và cung ứng sinh phẩm xét nghiệm, nghiêm cấm việc tăng giá hoặc đầu cơ, tích trữ và nghiêm túc thực hiện việc cập nhật, rà soát, công khai minh bạch về giá trên Cổng điện tử công khai giá. Đồng thời chịu trách nhiệm về giá công bố và tính chính xác, đầy đủ các thông tin liên quan đến hàng hóa theo quy định.
Bộ Y tế khẳng định cương quyết phòng chống tiêu cực, tham nhũng trong mua sắm, đấu thầu. Đối với những vấn đề liên quan đến tham nhũng, tiêu cực, lợi ích nhóm trong công tác phòng dịch, thời gian qua, Bộ Y tế đã có nhiều văn bản chỉ đạo, chấn chỉnh trong công tác mua sắm, đấu thầu và sử dụng trang thiết bị phòng chống dịch, trong đó có sinh phẩm xét nghiệm.
Bộ Y tế cho biết, việc nâng khống giá bộ xét nghiệm COVID-19 của Công ty Việt Á là rất nghiêm trọng, cần phải được xử lý nghiêm minh.
https://cand.com.vn/su-kien-binh-luan-thoi-su/bo-y-te-noi-gi-ve-vu-nang-khong-gia-test-kit-covid-19-cua-cong-ty-viet-a--i638820/
Không có nhận xét nào:
Đăng nhận xét